Hystérectomie

| CIM-9-CM Volume 3 | « 68.9 » |
|---|---|
| MeSH | « D007044 » |
L'hystérectomie est un acte chirurgical qui consiste à enlever l’utérus, en entier ou seulement une partie. Il peut également impliquer la suppression du col de l'utérus, des ovaires, des trompes de Fallope et d'autres structures environnantes.
Sommaire
1 Description
2 Histoire
3 Types
4 Utilisations médicales
4.1 Cancers gynécologiques
4.2 Chirurgie de réassignation sexuelle
5 Alternatives à l’hystérectomie, selon le cas
5.1 Saignements importants
5.2 Fibromes utérins
5.3 Prolapsus
6 Technique
6.1 Hystérectomie abdominale
6.2 Hystérectomie par voie vaginale
6.3 Hystérectomie par voie vaginale assistée par coelioscopie
6.4 Hystérectomie supracervicale assistée par coelioscopie
6.5 Hystérectomie laparoscopique totale
6.6 Autres techniques
7 Récupération
8 Comparaison des techniques
8.1 Voie vaginale
8.2 Laparotomie versus laparoscopie
8.3 Morcellation
8.4 Assistée par robot
8.5 Temps d'opération
8.6 Tableau récapitulatif
9 Effets indésirables
9.1 Mortalité et risques
9.2 Ovariectomie involontaire et Insuffisance ovarienne prématurée
9.3 Effets sur la vie sexuelle et Douleur pelvienne
9.4 Ménopause prématurée
9.5 Incontinence urinaire et Prolapsus vaginal
9.6 La formation d'adhérence et Obstruction de l'intestin
9.7 Infection
9.8 Autres problèmes rares
9.8.1 Carcinome rénal
9.8.2 Grossesse extra-utérine
9.8.3 Éviscération de l'intestin grêle
10 Fréquence
10.1 Canada
10.2 États-Unis
10.3 Royaume-Uni
10.4 Allemagne
10.5 Danemark
11 Voir aussi
12 Références
13 Liens externes
Description |
Habituellement réalisée par un gynécologue, l'hystérectomie peut être totale (retrait du corps, du fond de l'utérus et du col de l'utérus; souvent appelé "complet") ou partielle (ablation du corps utérin en laissant le col intact, également appelé "supracervical").
- On parle « d'hystérectomie totale » (« non conservatrice » ou « avec annexectomie ») si l'ablation comprend le corps et le col utérins.
- Elle est dite « subtotale » si on laisse en place le col utérin.
- On dit enfin hystérectomie « conservatrice » ou « interannexielle » si les ovaires et les trompes de Fallope sont laissés en place.
Plusieurs techniques chirurgicales sont proposées :
- par voie abdominale, avec incision abdominale médiane basse sus-pubienne, dite incision de Pfannenstiel (en) ;
- par voie laparoscopique (LAVH[1]) ;
- par voie vaginale, l’utérus étant extrait par les voies naturelles[2].
C'est la procédure chirurgicale gynécologique la plus couramment réalisée. En 2003, plus de 600 000 hystérectomies ont été réalisées seulement aux États-Unis, dont plus de 90% ont été réalisées pour des conditions bénignes[3]. Ces taux étant les plus élevés dans le monde industrialisé a conduit à la controverse majeure que les hystérectomies sont en grande partie effectuées pour des raisons injustifiées et inutiles[4].
L'ablation de l'utérus rend le patient incapable d'avoir des enfants (tout comme le retrait des ovaires et des trompes de fallope) et comporte des risques chirurgicaux ainsi que des effets à long terme. Cette chirurgie est donc généralement recommandée lorsque les autres options de traitement ne sont pas disponibles ou ont échoué. On s'attend à ce que la fréquence des hystérectomies pour les indications non malignes diminue car il existe de bonnes alternatives dans de nombreux cas[5].
L'ovariectomie (ablation des ovaires) est souvent réalisé en collaboration avec l'hystérectomie pour diminuer le risque de cancer de l'ovaire. Cependant, des études récentes ont montré que l'ovariectomie prophylactique sans indication médicale urgente diminue considérablement l'espérance de vie d'une femme et a d'autres effets indésirables graves[6],[7]. Cet effet n'est pas limité aux femmes pré-ménopausées ; même les femmes qui ont déjà atteint la ménopause ont montré une diminution de leur espérance de vie après l'ovariectomie[8]. Le terme vient du grec ὑστέρα, hystera, "utérus" et ἐκτομή, ektomḗ, "une coupe".
Histoire |
Dès 1862, Eugène Koeberlé est l'un des tout premiers à procéder avec succès à des hystérectomies sur des bases scientifiques. Avant la fin du siècle, des progrès essentiels sont obtenus par Jules-Émile Péan et Paul Segond dans l'hystérectomie vaginale appliquée au traitement des suppurations pelviennes (opération de Péan-Segond)[9],[10].
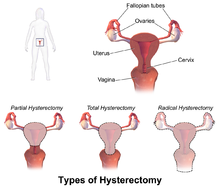
Types |

Dessin schématique des types d'hystérectomie
L'hystérectomie, au sens littéral du terme, signifie simplement l'ablation de l'utérus. Cependant, d'autres organes tels que les ovaires, les trompes de Fallope et le col de l'utérus sont très souvent retirés dans le cadre de la chirurgie.
L'hystérectomie radicale: la suppression complète de l'utérus, du col de l'utérus, de la partie supérieure du vagin, et du parametrium. Indiquée pour le cancer. Les ganglions lymphatiques, les ovaires et les trompes de Fallope sont généralement éliminés dans cette situation, comme pour l'hystérectomie de Wertheim[11].
Hystérectomie totale: ablation complète de l'utérus et du col de l'utérus, avec ou sans ovariectomie.
L'hystérectomie subtotale: ablation de l'utérus en laissant le col.
L'hystérectomie subtotale (supracervicale) a été proposée dans l'espoir d'améliorer le fonctionnement sexuel après hystérectomie.
On a postulé que le retrait du col provoque une perturbation neurologique et anatomique excessive, entraînant un raccourcissement vaginal, un prolapsus de la voûte vaginale, et des granulations de la coiffe vaginale. Ces avantages théoriques n'ont pas été confirmés dans la pratique, mais d'autres avantages par rapport à une hystérectomie totale ont émergé.
Le principal inconvénient est que le risque de cancer du col de l'utérus n'est pas éliminé et que les femmes peuvent continuer à avoir des saignements cycliques (bien que sensiblement moins qu'avant la chirurgie).
Ces questions ont été abordées dans une revue systématique de l'hystérectomie totale versus supracervicale pour les conditions gynécologiques bénignes, qui ont rapporté les résultats suivants[12] :
- Il n'y avait aucune différence dans les taux d'incontinence, la constipation, les mesures de la fonction sexuelle ou l'atténuation des symptômes pré-opératoires.
- La durée de la chirurgie et la quantité de sang perdue au cours de la chirurgie étaient significativement réduites durant l'hystérectomie supracervicale par rapport à l'hystérectomie totale, mais il n'y avait pas de différence dans les taux de transfusion post-opératoire.
- La morbidité fébrile était moins probable et un saignement vaginal cyclique en cours un an après la chirurgie était plus probable après une hystérectomie supracervicale.
- Il n'y avait pas de différence dans les taux d'autres complications, de rétablissement ou de réadmission.
À court terme, des essais randomisés ont montré que la préservation ou l'élimination du col n'affecte pas le taux de prolapsus ultérieur des organes pelviens[13].
L'hystérectomie supracervicale n'élimine pas la possibilité d'avoir un cancer du col puisque le col lui-même est laissé intact, et peut donc être contre-indiqué chez les femmes ayant un risque accru de ce cancer; des frottis de pap réguliers pour dépister la dysplasie cervicale ou le cancer sont encore nécessaires[14],[15].
Utilisations médicales |
L'hystérectomie
L'hystérectomie est une intervention chirurgicale majeure qui comporte des risques et des avantages, et qui affecte l'équilibre hormonal et la santé générale de la femme pour le reste de sa vie. Pour cette raison, l'hystérectomie est normalement recommandée en dernier recours pour remédier à certaines conditions intraitables du système utérin / reproducteur. Ces conditions incluent, mais ne sont pas limitées à :
Endométriose sévère et réfractaire (croissance de la muqueuse utérine en dehors de la cavité utérine) et / ou adénomyose (une forme d'endométriose, où la muqueuse utérine s'est développée et parfois à travers la paroi musculaire utérine), après épuisement des autres options pharmaceutiques ou chirurgicales[16],[17].- Douleur pelvienne chronique, après épuisement des autres options pharmaceutiques ou chirurgicales[16],[17].
Après l'accouchement pour éliminer soit un cas grave de placenta praevia (un placenta qui s'est formé au-dessus ou à l'intérieur du canal génital), soit un placenta percreta (un placenta qui s'est développé dans et à travers la paroi de l'utérus pour se fixer à d'autres organes). en dernier recours en cas d'hémorragie obstétricale excessive[18].- Plusieurs formes de prolapsus vaginaux[16],[17].
Les femmes peuvent également exprimer le désir de subir une hystérectomie élective pour des raisons autres que la résolution des conditions du système reproducteur ou des maladies. Certaines des conditions dans lesquelles une personne peut demander une hystérectomie (ou en demander une si la femme est incapable de faire la demande) pour des raisons autres que la maladie peuvent être une prophylaxie contre certains cancers du système reproducteur, surtout s'il existe de nombreux antécédents familiaux de cancers du système reproducteur (en particulier le cancer du sein en collaboration avec les gènes BRCA1 ou BRCA2) ou dans le cadre de la guérison de tels cancers. Certaines personnes ayant de graves troubles du développement ont eu des hystérectomies, bien que ce traitement soit au mieux controversé. Aux États-Unis, les tribunaux suprêmes de l'État ont jugé que des cas particuliers de stérilisation attribuable à des déficiences développementales violaient les droits constitutionnels et de common law du patient[19].
Cancers gynécologiques |
De nombreux types de cancers du système reproducteur sont traités chirurgicalement. Ceux-ci comprennent l'utérus, du col de l'utérus, de l'ovaire, de l'endomètre ou des tumeurs; ainsi que les fibromes utérins qui ne répondent pas à des options de traitement plus conservatrices[16].
Chirurgie de réassignation sexuelle |
Les hystérectomies électives avec salpingo-ovariectomie bilatérale sont souvent pratiquées avant ou dans le cadre d'une chirurgie de réassignation sexuelle pour les hommes trans. Certains hommes choisissent d'opter pour une hormonothérapie substitutive au début de leur transition sexuelle afin d'éviter les complications liées à l'utilisation de testostérone, tout en ayant des organes producteurs d'hormones femelles (p. ex., cancer de l'utérus et coronaropathie) ou pour retirer autant de sources d'hormones sexuelles féminines que possible afin de mieux "passer" pendant les expériences de vie réelle de leur transition. D'autres préfèrent attendre d'avoir une "chirurgie du bas" complète (retrait des organes sexuels féminins et construction d'une anatomie externe d'apparence masculine) pour éviter de subir plusieurs opérations séparées.[réf. nécessaire]
Alternatives à l’hystérectomie, selon le cas |
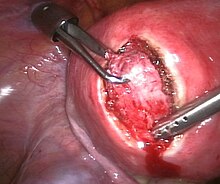
La myomectomie
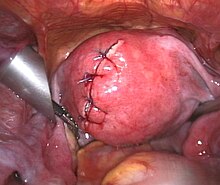
Suture de l'utérus après une myomectomie
Saignements importants |
Les dispositifs intra-utérins au lévonorgestrel sont très efficaces pour contrôler les saignements utérins anormaux (DUB) ou les ménorragies et devraient être envisagés avant toute chirurgie[20].
La ménorragie (saignements menstruels abondants ou anormaux) peut également être traitée par l'ablation de l'endomètre qui est une intervention ambulatoire moins invasive dans laquelle la muqueuse de l'utérus est détruite par la chaleur, mécaniquement ou par radiofréquence. L'ablation de l'endomètre réduit considérablement ou élimine entièrement les saignements mensuels chez quatre-vingt-dix pour cent des patients atteints de DUB. Il n'est pas efficace pour les patients présentant une muqueuse utérine très épaisse ou des fibromes utérins[21].
Fibromes utérins |
Les dispositifs intra-utérins au lévonorgestrel sont très efficaces pour limiter le flux menstruel et améliorer d'autres symptômes. Les effets secondaires sont généralement très modérés parce que le lévonorgestrel (un progestatif) est libéré localement avec une faible concentration. Il existe aujourd'hui des preuves substantielles que Levongestrel-DIU offrent un bon soulagement dans le cas de fibromes[22].
Les fibromes utérins peuvent être enlevés et l'utérus reconstruit dans une procédure appelée "myomectomie." Une myomectomie peut être effectuée par une incision ouverte, par laparoscopie ou par le vagin (hystéroscopie)[23].
L'embolisation de l'artère utérine (UAE) est une procédure peu invasive pour le traitement des fibromes utérins.
Sous anesthésie locale, un cathéter est introduit dans l'artère fémorale au pli de l'aine et déplacé sous contrôle radiographique dans l'artère utérine. Une masse de microsphères ou d'alcool polyvinylique (PVA) est injectée dans les artères utérines afin de bloquer l'écoulement du sang à travers ces vaisseaux. La restriction de l'approvisionnement en sang entraîne une réduction significative du nombre de fibromes et limite les saignements abondants.
La revue Cochrane 2012 comparant l'hystérectomie et les UAE n'a trouvée aucun avantage majeur pour l'une ou l'autre procédure. Alors que les UAE sont associés à un séjour hospitalier plus court et à un retour plus rapide aux activités quotidiennes normales, ils étaient également associés à un risque plus élevé de complications mineures plus tard. Il n'y avait pas de différences entre les UAE et l'hystérectomie en ce qui concerne les complications majeures[24].
Les fibromes utérins peuvent être enlevés avec une procédure non invasive appelée Ultrasons focalisés de haute intensité (MRgFUS).
Prolapsus |
Le prolapsus peut également être corrigée chirurgicalement sans ablation de l'utérus[25].
Technique |
L'hystérectomie peut être réalisée de différentes manières. La plus ancienne technique est l'incision abdominale. Par la suite, ont été développées la technique vaginale (en effectuant l'hystérectomie par le canal vaginal) et plus tard, les techniques vaginales laparoscopiques (avec des instruments supplémentaires insérés à travers un petit trou, fréquemment proche du nombril).
Hystérectomie abdominale |
La plupart des hystérectomies des États-Unis sont réalisés par laparotomie (incision abdominale, à ne pas confondre avec la laparoscopie). Elle est utilisée par exemple après une césarienne, dans le cas d'un cancer, lorsque des complications sont à prévoir ou qu'une exploration chirurgicale est nécessaire.
Une incision transversale (Pfannenstiel) généralement au-dessus de l'os pubien, aussi près que possible de la ligne supérieure des poils du bassin de la personne, semblable à l'incision pratiquée pour une césarienne.
Cette technique permet aux médecins d'avoir le meilleur accès aux structures reproductives et est normalement effectuée pour l'élimination de l'ensemble du complexe reproducteur.
Une hystérectomie ouverte fournit le moyen le plus efficace d'explorer la cavité abdominale et d'effectuer des chirurgies compliquées. Avant l'amélioration des techniques vaginales et laparoscopiques, c'était aussi la seule possibilité d'obtenir une hystérectomie subtotale, alors que la voie vaginale est la technique préférée dans la plupart des cas[26],[27].
Le temps de récupération pour cette hystérectomie ouverte est de 4-6 semaines et parfois plus longtemps en raison de la nécessité de couper à travers la paroi abdominale.
Historiquement, le plus gros problème de cette technique était les infections, mais les taux d'infection sont bien contrôlés et ne sont plus une préoccupation majeure dans la pratique médicale moderne.
Hystérectomie par voie vaginale |
L'hystérectomie vaginale est réalisée entièrement par le canal vaginal et présente des avantages évidents par rapport à la chirurgie abdominale, comme la réduction des complications, la réduction du séjour à l'hôpital et la réduction du temps de guérison.
Hystérectomie par voie vaginale assistée par coelioscopie |
Avec le développement des techniques laparoscopiques dans les années 1970 et 1980, l'«hystérectomie vaginale assistée par laparoscopie» (LAVH) a gagné en popularité auprès des gynécologues car elle est moins invasive que la procédure abdominale et la récupération postopératoire est beaucoup plus rapide. Il permet également une meilleure exploration et des chirurgies légèrement plus compliquées que la procédure vaginale.
La LAVH commence par la laparoscopie et se termine par l'ablation définitive de l'utérus (avec ou sans retrait des ovaires) par le canal vaginal. Ainsi, LAVH est également une hystérectomie totale; le col de l'utérus doit être retiré avec l'utérus.
Hystérectomie supracervicale assistée par coelioscopie |
L '«hystérectomie supracervicale assistée par laparoscopie» (LASH) a été développée plus tard pour retirer l'utérus sans retirer le col en utilisant un morcellateur qui coupe l'utérus en petits morceaux qui peuvent être retirés de la cavité abdominale via les orifices laparoscopiques.
Hystérectomie laparoscopique totale |
L'hystérectomie laparoscopique totale (TLH) a été développée au début des années 1990 par Prabhat K. Ahluwalia dans l'État de New York[28]. La TLH est réalisée uniquement par les laparoscopes dans l'abdomen, en commençant au sommet de l'utérus, généralement avec un manipulateur utérin. L'utérus entier est déconnecté de ses attaches en utilisant de longs instruments minces à travers les «ports». Ensuite, tous les tissus à enlever sont passés à travers les petites incisions abdominales.
Autres techniques |
L'hystérectomie laparoscopique (subtotale) (LSH) est réalisée de manière similaire à la chirurgie laparoscopique totale mais l'utérus est coupée entre le col de l'utérus et le fundus.
La laparoscopie à double orifice est une forme de chirurgie laparoscopique utilisant deux incisions de 5 mm à mi-hauteur : l'utérus est détaché par les deux orifices et évacué par le vagin[29],[30].
L'«hystérectomie assistée par robot» est une variante de la chirurgie laparoscopique utilisant des instruments spéciaux contrôlés à distance qui permettent au chirurgien un contrôle plus fin ainsi qu'une vision grossie en trois dimensions[31].
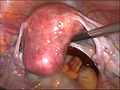
L'utérus avant l'hystérectomie
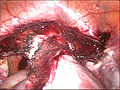
Hystérectomie laparoscopique
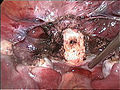
Moignon cervical (blanc) après l'ablation du corps utérin lors de l'hystérectomie supracervicale laparoscopique

Extraction vaginale de l'utérus lors d'une hystérectomie laparoscopique totale
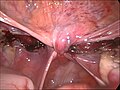
Fin d'une hystérectomie laparoscopique
Récupération |
Le séjour à l'hôpital est de 3 à 5 jours ou plus pour la procédure abdominale, et entre 1 et 2 jours (mais peut être plus long) pour les procédures vaginales et vaginales assistées par laparoscopie[32].
Comparaison des techniques |
Les caractéristiques du patient telles que la raison de l'hystérectomie, la taille de l'utérus, la descente de l'utérus, la présence de tissus malades entourant l'utérus, la chirurgie antérieure dans la région pelvienne, l'obésité, l'histoire de la grossesse, la possibilité d'endométriose, ou la nécessité d'une ovariectomie, influencera l'approche chirurgicale lors de l'hystérectomie[33].
Voie vaginale |
L'hystérectomie par voie vaginale, quand elle est possible, est plus recommandée que d'autres variantes pour les femmes atteintes de maladies bénignes[26],[27],[33]. L'hystérectomie vaginale s'est révélée meilleure que la LAVH et que certains types de chirurgie laparoscopique, entraînant moins de complications à court et à long terme, un effet plus favorable sur l'expérience sexuelle avec des temps de récupération plus courts et des coûts moindres[34],[35],[36].
L'hystérectomie vaginale est la seule option disponible qui soit réalisable sans anesthésie totale ou en ambulatoire (bien que le faire sans anesthésie ne soit recommandé que dans des cas exceptionnels).[réf. nécessaire]
Laparotomie versus laparoscopie |
La chirurgie laparoscopique offre certains avantages lorsque la chirurgie vaginale n'est pas possible, mais l'opération a aussi l'inconvénient de prendre beaucoup plus de temps[33] avec un taux plus élevé de complications majeures, tout en offrant une guérison beaucoup plus rapide[37].
En cas d'hystérectomie totale pour cancer de l'endomètre, la procédure par laparoscopie offre des résultats périopératoires améliorés avec un taux de réopération inférieur et moins de complications postopératoires que la laparotomie[38].
La technique abdominale (laparotomie) est très souvent appliquée dans des circonstances difficiles ou lorsque des complications sont attendues. Compte tenu de ces circonstances, le taux de complications et le temps requis pour la chirurgie se compare très favorablement avec d'autres techniques, mais le temps nécessaire pour la guérison est beaucoup plus long[33]. Elle est corrélée à une incidence beaucoup plus élevée d'adhérences intestinales que les autres techniques[39].
Morcellation |
La morcellation a été largement utilisée, surtout dans les techniques laparoscopiques et parfois pour la technique vaginale, mais elle semble aujourd'hui associée à un risque accru de propagation de tumeurs bénignes ou malignes[40],[41]. En avril 2014, la FDA a émis une alerte destinée aux professionnels de la santé sur les risques de la morcellation[42].
Assistée par robot |
La chirurgie assistée par robot est actuellement utilisée dans plusieurs pays pour les hystérectomies. Des recherches supplémentaires sont nécessaires pour déterminer les avantages et les risques associés, par rapport à la chirurgie laparoscopique conventionnelle[43].
Une revue de 2014, Cochrane, a montré que la chirurgie assistée par robot semble avoir un taux de complications similaire à celui de la chirurgie laparoscopique conventionnelle. En outre, il existe des preuves suggérant que même si la chirurgie prend plus de temps, la chirurgie assistée par robot peut entraîner une hospitalisation plus courte. Plus de recherches sont nécessaires pour déterminer si les hystérectomies assistées par robot sont bénéfiques pour les personnes atteintes de cancer.
Les avantages marginaux précédemment rapportés de la chirurgie assistée par robot n'ont pas pu être confirmés; seules les différences de séjour hospitalier et de coût restent statistiquement significatives[44],[45],[46],[47],[48]. En outre, des préoccupations au sujet d'allégations commerciales trompeuses généralisées ont été soulevées[49].
Temps d'opération |
Le temps requis pour l'achèvement de la chirurgie dans les tests eVAL est[37] :
- abdominale 55.2 minutes en moyenne, dans une fourchette allant de 19 à 155 minutes
- vaginale 46.6 minutes en moyenne, dans une fourchette allant de 14 à 168 minutes
- laparoscopique (toutes les variantes) 82.5 minutes en moyenne, dans une fourchette allant de 10 à 325 minutes (données combinées des deux groupes de l'essai)
Tableau récapitulatif |
| Technique | Avantages | Inconvénients |
|---|---|---|
| Hystérectomie abdominale |
|
|
| Hystérectomie vaginale |
|
|
| Hystérectomie supracervicale laparoscopique (hystérectomie subtotale) |
|
|
| Hystérectomie vaginale assistée par laparoscopie (LAVH) |
|
|
| Hystérectomie laparoscopique totale |
|
|
| Hystérectomie laparoscopique à un seul orifice / mini-hystérectomie laparoscopique |
| |
| Hystérectomie assistée par robot |
|
|
Effets indésirables |
L'hystérectomie a, comme toute autre chirurgie, certains risques et effets secondaires.
Mortalité et risques |
En 1995, la mortalité à court terme (dans un délai de 40 jours à compter de la chirurgie) a été signalé à 0,38 cas pour 1000 lorsqu'elle est effectuée pour des causes bénignes. Les risques de complications chirurgicales ont été la présence de fibromes, le jeune âge (bassin vasculaire avec un risque de saignement plus élevé et un utérus plus grand), des saignements utérins dysfonctionnels et la parité[54].
Le taux de mortalité est plusieurs fois plus élevé chez les patients enceints, atteints d'un cancer ou d'autres complications[55].
L'effet à long terme sur toutes les causes de mortalité est relativement faible. Les femmes de moins de 45 ans ont une mortalité à long terme significativement accrue que l'on pense être causée par les effets secondaires hormonaux de l'hystérectomie et de l'ovariectomie prophylactique[6].
Environ 35% des femmes ayant subi une hystérectomie subissent une autre intervention chirurgicale liée dans les deux années suivantes.
La lésion urétérale n'est pas rare et survient dans 0,2 cas d'hystérectomie vaginale sur 1 000 et 1,3 cas d'hystérectomie abdominale pour 1 000[56]. La lésion se produit habituellement dans l'uretère distal près du ligament infundibulo-pelvien ou de l'uretère qui passe en dessous de l'artère utérine, souvent en raison d'un serrage à l'aveugle ou d'un placement de ligature pour contrôler l'hémorragie[57].
Ovariectomie involontaire et Insuffisance ovarienne prématurée |
L'ablation de l'un ou des deux ovaires est effectuée dans un nombre important d'hystérectomies pour lesquelles ce n'était pas prévu[58].
L'âge moyen de la ménopause après une hystérectomie avec conservation de l'ovaire est de 3,7 ans plus tôt que la moyenne[59]. Il a été suggéré que ça peut être dû à la perturbation de l'approvisionnement en sang aux ovaires ou du manque de rétroaction endocrinienne de l'utérus.
La fonction des ovaires restants est significativement affectée chez environ 40% des femmes, certaines d'entre elles nécessitant même un traitement hormonal substitutif.
De façon surprenante, un effet similaire et légèrement plus faible a été observé pour l'ablation de l'endomètre, qui est souvent considéré comme une alternative à l'hystérectomie.
Un nombre important de femmes développent des kystes ovariens bénins après une hystérectomie[60].
Effets sur la vie sexuelle et Douleur pelvienne |
Après l'hystérectomie pour les indications bénignes, la majorité des femmes rapportent une amélioration de la vie sexuelle et des douleurs pelviennes. Une proportion plus faible de femmes signalent une aggravation de la vie sexuelle et d'autres problèmes.
Les retours sont significativement différents pour l'hystérectomie réalisée pour des raisons malignes; la procédure est souvent plus radicale avec des effets secondaires importants[61],[62].
Une proportion de patients qui subissent une hystérectomie pour douleurs pelviennes chroniques continuent de souffrir de douleurs pelviennes après une hystérectomie et développent une dyspareunie (rapports sexuels douloureux)[63].
Ménopause prématurée |
Les niveaux d'œstrogène tombent brusquement quand les ovaires sont enlevés, enlevant les effets protecteurs d'œstrogène sur les systèmes cardio-vasculaires et squelettiques.
Cette condition est souvent appelée «ménopause chirurgicale», bien qu'elle soit sensiblement différente d'un état ménopausique naturel; le premier est un choc hormonal soudain pour le corps qui provoque l'apparition rapide de symptômes ménopausiques tels que les bouffées de chaleur, tandis que le second est une diminution graduelle des niveaux hormonaux pendant des années avec l'utérus intact et les ovaires capables de produire des hormones même après la cessation des règles.
Une étude a montré que les risques de récidive de maladies cardiovasculaires est sensiblement augmenté pour les personnes ayant subi une hystérectomie à l'âge de 50 ans ou moins. Aucune association n'a été trouvé pour les personnes subissant la procédure après l'âge de 50 ans. Le risque est plus élevé lorsque les ovaires sont enlevés, mais même lorsque les ovaires sont conservés il est toujours perceptible[64].
Plusieurs autres études ont montré que l'ostéoporose (diminution de la densité osseuse) et le risque accru de fractures osseuses sont associés à des hystérectomies[65],[66],[67],[68],[69],[70]. Cela a été attribué à l'effet modulateur de l'œstrogène sur le métabolisme du calcium et la chute des taux sériques d'œstrogènes après la ménopause peut entraîner une perte excessive de calcium conduisant à une atrophie osseuse.
Les hystérectomies ont aussi été liées à des taux plus élevés de maladies cardiaques et de l'affaiblissement des os. Les personnes qui ont subi une hystérectomie avec le retrait des deux ovaires ont généralement des niveaux réduits de testostérone[58]. la Les niveaux réduits de testostérone chez les femmes sont prédictifs de la perte de taille, qui peut résulter de la réduction de la densité osseuse[71], tandis que les niveaux accrus de testostérone chez les femmes sont associés à un plus grand sentiment de désir sexuel[72].
L'ovariectomie avant l'âge de 45 ans est associée à une multiplication par cinq de la mortalité due aux troubles neurologiques et mentaux[73].
Incontinence urinaire et Prolapsus vaginal |
L'incontinence urinaire et prolapsus vaginal sont des effets indésirables bien connus qui se développent à haute fréquence très longtemps après la chirurgie, généralement 10 à 20 ans après la chirurgie[74].
Pour cette raison, les chiffres exacts ne sont pas connus et les facteurs de risque sont mal compris. On ignore également si le choix de la technique chirurgicale a un effet.
Il a été évalué que le risque d'incontinence urinaire est approximativement doublé dans les 20 ans suivant l'hystérectomie. Une étude à long terme a révélé un risque multiplié par 2,4 de chirurgie pour corriger l'incontinence urinaire due à un effort après une hystérectomie[75],[76].
Le risque de prolapsus vaginal dépend de facteurs tels que le nombre d'accouchements vaginaux, la difficulté de ces accouchements et le type de travail[77]. La fréquence globale est approximativement doublée après l'hystérectomie[78].
La formation d'adhérence et Obstruction de l'intestin |
La formation d'adhérences est un risque particulier après l'hystérectomie en raison de l'étendue de la dissection pratiquée, ainsi que le fait que la plaie de l'hystérectomie se trouve dans la partie du bassin la plus dépendante de la gravité dans laquelle une boucle de l'intestin peut facilement tomber[79].
Dans une étude, l'incidence de l'obstruction de l'intestin grêle due à l'adhérence intestinale était de 15,6% dans les hystérectomies abdominales totales non laparoscopiques contre 0,0% dans les hystérectomies laparoscopiques[39].
Infection |
L'infection de la plaie survient dans environ 3% des cas d'hystérectomie abdominale. Le risque est accru par l'obésité, le diabète, le trouble de l'immunodéficience, l'utilisation de corticostéroïdes systémiques, le tabagisme, la présence d'un bleu près des plaies et les infections préexistantes telles que la chorioamnionite et la maladie inflammatoire pelvienne[80].
Ces infections des plaies prennent souvent la forme d'un abcès incisionnel ou d'une blessure de la cellulite. En général, les deux produisent un érythème, mais seule l'incision d'abcès produit un écoulement purulent.
Le traitement recommandé d'un abcès incisionnel après une hystérectomie est l'incision et le drainage, et puis la couverture par une mince couche de gaze et d'un pansement stérile. Le pansement doit être changé et la plaie irriguée avec une solution saline normale au moins deux fois par jour. En outre, il est recommandé d'administrer un antibiotique actif contre les staphylocoques et les streptocoques, de préférence à la vancomycine lorsqu'il existe un risque de SARM[80].
La plaie peut être fermée par intention secondaire. Alternativement, si l'infection est éliminée et qu'un tissu de granulation sain est visible à la base de la plaie, les bords de l'incision peuvent être réapproximés, par exemple en utilisant des points de papillon, des agrafes ou des points de suture[80].
Les rapports sexuels restent possibles après l'hystérectomie.
La chirurgie reconstructive reste une option pour les femmes qui ont connu des conditions bénignes et malignes[81]. :1020–1348
Autres problèmes rares |
Carcinome rénal |
L'hystérectomie peut entraîner un risque accru de carcinome rénal relativement rare. Le risque accru est particulièrement prononcé pour les jeunes femmes et il est plus faible par voie vaginale[82].
Des effets hormonaux ou une lésion de l'uretère ont été considérés comme des explications possibles[83],[84]. Dans certains cas, le carcinome à cellules rénales peut être une manifestation d'une léiomyomatose héréditaire non diagnostiquée.
Grossesse extra-utérine |
L'ablation de l'utérus sans retirer les ovaires peut aboutir à une situation qui, en de rares occasions, peut entraîner une grossesse extra-utérine due à une fécondation non détectée qui doit encore descendre dans l'utérus avant la chirurgie.
Deux cas ont été présentés dans un numéro du Blackwell Journal of Obstetrics and Gynecology; plus de 20 autres cas ont été discutés dans la littérature médicale supplémentaire[85].
Éviscération de l'intestin grêle |
En de très rares occasions, les rapports sexuels après une hystérectomie peuvent provoquer une éviscération transvaginale de l'intestin grêle[86].
Fréquence |
Canada |
Au Canada, le nombre d'hystérectomies pratiquées entre 2008 et 2009 était environ de 47 000. Le taux national pour cette période était de 338 pour 100 000 habitants, contre 484 pour 100 000 en 1997. Les raisons de l'hystérectomie différaient selon que la personne était issue du milieu urbain ou rural. Les personnes urbaines ont opté pour des hystérectomies en raison de fibromes utérins, celles rurales principalement pour des troubles du cycle menstruel[87].
États-Unis |
Selon le National Center for Health Statistics, , sur les 617 000 hystérectomies réalisées en 2004, 73% concernaient également l'ablation chirurgicale des ovaires. Aux États-Unis, une femme sur trois de 60 ans aura fait une hystérectomie[88]. On estime actuellement que 22 millions de personnes aux États-Unis ont subi cette intervention.
Selon la même source, l'hystérectomie est la deuxième chirurgie majeure la plus fréquente chez les femmes aux États-Unis (la première est la césarienne). Dans les années 1980 et 1990, cette statistique a été source d'inquiétude chez certains groupes de défense des droits des consommateurs et de perplexité parmi la communauté médicale[89], et a amené à la création de groupes de défense des choix éclairés comme la HERSTERECTOMY Educational Resources and Services (HERS), fondée par Nora W. Coffey en 1982.
Royaume-Uni |
Au Royaume-Uni, une femme sur cinq est susceptible d'avoir eu une hystérectomie à l'âge de 60 ans, et les ovaires sont éliminés dans environ 20% des cas[90].
Allemagne |
Le nombre d'hystérectomies en Allemagne est constant depuis de nombreuses années. En 2006, 149 456 hystérectomies ont été réalisées, parmi celles-ci, 126 743 (84,8%) étaient sans incident. Les femmes âgées de 40 à 49 ans représentaient 50% des hystérectomies, et celles âgées entre 50 et 59 ans en représentaient 20%[91]. En 2007, le nombre d'hystérectomies a chuté à 138 164[92]. Ces dernières années, les techniques d'hystérectomies laparoscopiques ou assistées par laparoscopie se sont popularisées[93],[94].
Danemark |
Au Danemark, le nombre d'hystérectomies des années 1980 à 1990 a diminué de 38%. En 1988, il y avait 173 chirurgies de ce genre pour 100 000 femmes et, en 1998, ce nombre avait été réduit à 107. La proportion d'hystérectomies abdominales supracervicales au cours de la même période est passée de 7,5 à 41%. Un total de 67 096 femmes ont subi une hystérectomie au cours de ces années[95].
Voir aussi |
- Liste des opérations par type
Références |
(en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Hysterectomy » (voir la liste des auteurs).
Laparoscopie, Hôpitaux universitaires de Genève (consulté le 12 avril 2011).
Jacques Peter, Philippe Boisselier et E.Guttila, Journal de gynécologie, obstétrique et biologie de la reproduction, « Hystérectomie vaginale sur utérus non prolabé » [PDF], sur http://alcciago.free.fr, 1987(consulté le 24 décembre 2017), p. 925-934.
« Hysterectomy rates in the United States, 2003 », Obstet Gynecol, vol. 110, no 5, 2007, p. 1091–5 (PMID 17978124, DOI 10.1097/01.AOG.0000285997.38553.4b)
Coco Masters, « Are Hysterectomies Too Common? », TIME Magazine, 1er juillet 2006(lire en ligne)
L. Bahamondes, M. V. Bahamondes et I. Monteiro, « Levonorgestrel-releasing intrauterine system: uses and controversies », Expert Review of Medical Devices, vol. 5, no 4, 2008, p. 437–445 (PMID 18573044, DOI 10.1586/17434440.5.4.437)
L. T. Shuster, B. S. Gostout, B. R. Grossardt et W. A. Rocca, « Prophylactic oophorectomy in premenopausal people and long-term health », Menopause International, vol. 14, no 3, 2008, p. 111–116 (PMID 18714076, PMCID 2585770, DOI 10.1258/mi.2008.008016)
American Urogynecologic Society, Five Things Physicians and Patients Should Question, American Urogynecologic Society, 5 mai 2015(lire en ligne), which cites: *SV Blank, « Prophylactic and risk-reducing bilateral salpingo-oophorectomy: recommendations based on risk of ovarian cancer », Obstetrics and gynecology, vol. 117, no 2 Pt 1, février 2011, p. 404; author reply 404 (PMID 21252760, DOI 10.1097/AOG.0b013e3182083189)
D. Shoupe, W. H. Parker, M. S. Broder, Z. Liu, C. Farquhar et J. S. Berek, « Elective oophorectomy for benign gynecological disorders », Menopause, vol. 14, no Suppl. 1, 2007, p. 580–585 (PMID 17476148, DOI 10.1097/gme.0b013e31803c56a4)
Paul Éloi Bégouin, Henri Bourgeois, Pierre Duval, Antonin Gosset, Émile Jeanbrau, Félix Papin et al., Précis de pathologie chirurgicale, t. 5 : Appareil génital de l'homme, pathologie urinaire, gynécologie, Masson et Cie, coll. « Précis médicaux », 1937, 6e éd. (1re éd. 1928), 1299 p., p. 879.
Paul Segond, Traitement des grossesses extra-utérines, Paris, L. Maretheux, 1898 ; réédition : Nabu Press, février 2010 (ISBN 978-1-145-00897-7).
encyclopedia.com > Wertheim's hysterectomy Citing: "Wertheim's hysterectomy." A Dictionary of Nursing. 2008. Encyclopedia.com. (October 13, 2010).
A. Lethaby, A. Mukhopadhyay, R. Naik et Anne Lethaby (dir.), « Total versus subtotal hysterectomy for benign gynaecological conditions », Cochrane Database Syst Rev, vol. 4, no 4, 2012, CD004993 (PMID 22513925, DOI 10.1002/14651858.CD004993.pub3)
R. Thakar, S. Ayers, P. Clarkson, S. Stanton et I. Manyonda, « Outcomes after Total versus Subtotal abdominal hysterectomy », N Engl J Med, vol. 347, no 17, 2002, p. 1318–25 (PMID 12397189, DOI 10.1056/NEJMoa013336)
American Academy of Family Physicians, « Five Things Physicians and Patients Should Question », Choosing Wisely: an initiative of the ABIM Foundation, American Academy of Family Physicians, avril 2012(lire en ligne[archive du 24 juin 2012])
Consumer Reports et American Academy of Family Physicians, « Pap tests: When you need them—and when you don't », Choosing Wisely: an initiative of the ABIM Foundation, Consumer Reports, mai 2012(lire en ligne)
The National Women's Health Information Center, « Hysterectomy Frequently Asked Questions », Washington, DC, Office of Women's Health, United States Department of Health and Human Services, 15 décembre 2009(consulté le 10 mars 2011)
« Hysterectomy », U.S. Department of Health and Human Services National Institutes of Health, U.S. National Library of Medicine, 24 mai 2017(consulté le 17 juin 2017)
R. Roopnarinesingh, L. Fay et P. McKenna, « A 27-year review of obstetric hysterectomy », Journal of obstetrics and gynaecology, vol. 23, no 3, 2003, p. 252–4 (PMID 12850853, DOI 10.1080/0144361031000098352)
Washington (state) Protection and Advocacy System, « Growth Attenuation and Sterilization Procedures – "The Ashley Treatment" » [archive du 27 juillet 2011], Washington, DC, National Disabilities Rights Network (consulté le 10 mars 2011)
Milsom I, « The levonorgestrel-releasing intrauterine system as an alternative to hysterectomy in peri-menopausal women », Contraception, vol. 75, no 6, 2007, S152–S154 (PMID 17531608, DOI 10.1016/j.contraception.2007.01.003)
Curt Pesmen, « 5 operations you don't want to get – and what to do instead », CNN, 27 juillet 2007(lire en ligne)
LB. Zapata, MK. Whiteman, N. K. Tepper, D. J. Jamieson, P. A. Marchbanks et K. M. Curtis, « Intrauterine device use among women with uterine fibroids: a systematic review☆ », Contraception, vol. 82, no 1, 2010, p. 41–55 (PMID 20682142, DOI 10.1016/j.contraception.2010.02.011)
Parker, William H. and Parker, Rachel L. (2002) "A Gynecologist's Second Opinion: The Questions & Answers You Need to Take Charge of Your Health, " Plume; Rev ed., 89–92, 105–150.
Janesh K. Gupta, Anju Sinha, M. A. Lumsden et Martha Hickey, « Uterine artery embolization for symptomatic uterine fibroids », The Cochrane Database of Systematic Reviews, no 12, 26 décembre 2014, CD005073 (ISSN 1469-493X, PMID 25541260, DOI 10.1002/14651858.CD005073.pub4)
Frederick R. Jelovsek, "Having Prolapse, Cystocele and Rectocele Fixed Without Hysterectomy"
« Subtotal hysterectomy and myomectomy – Vaginally », Best Practice & Research Clinical Obstetrics & Gynaecology, vol. 25, no 2, 2011, p. 133–152 (PMID 21185235, DOI 10.1016/j.bpobgyn.2010.11.003)
« Vaginal route: A gynaecological route for much more than hysterectomy », Best Practice & Research Clinical Obstetrics & Gynaecology, vol. 25, no 2, 2011, p. 115–132 (PMID 21349773, DOI 10.1016/j.bpobgyn.2010.12.005)
Ahluwalia PK, « Total Laparoscopic Hysterectomy », The Journal of the American Association of Gynecologic Laparoscopists, vol. 3, no 4, Supplement, août 1996, S1–2 (PMID 9074073)
« A Novel Approach to Total Laparoscopic Hysterectomy Using Only Two 5mm Ports: Initial Clinical Experience », Journal of Minimally Invasive Gynecology, vol. 17, no 6, 2010, S87 (DOI 10.1016/j.jmig.2010.08.381)
« Dual Port Hysterectomy: A Novel Technique and Initial Experience », Journal of Minimally Invasive Gynecology, vol. 19, no 6, 2012, S86 (DOI 10.1016/j.jmig.2012.08.620)
Medline Plus: Robotic surgery
What you can expect, Mayo Clinic
Johanna W. M. Aarts, Theodoor E. Nieboer, Neil Johnson et Emma Tavender, « Surgical approach to hysterectomy for benign gynaecological disease », The Cochrane Database of Systematic Reviews, no 8, 12 août 2015, CD003677 (ISSN 1469-493X, PMID 26264829, DOI 10.1002/14651858.CD003677.pub5)
« Laparoscopic Hysterectomy – is There a Benefit? », New England Journal of Medicine, vol. 335, no 7, 1996, p. 512–513 (PMID 8672159, DOI 10.1056/NEJM199608153350712)
« Laparoscopic Hysterectomy and Health Care in America – Finding the Balance Between Costs and Outcomes » (consulté le 24 janvier 2010)
Debodinance P, « Hysterectomy for benign lesions in the north of France: epidemiology and postoperative events », Journal de gynecologie, obstetrique et biologie de la reproduction, vol. 30, no 2, 2001, p. 151–9 (PMID 11319467)
« The eVALuate study: two parallel randomised trials, one comparing laparoscopic with abdominal hysterectomy, the other comparing laparoscopic with vaginal hysterectomy », BMJ (Clinical research ed.), vol. 328, no 7432, 2004, p. 129 (PMID 14711749, PMCID 314503, DOI 10.1136/bmj.37984.623889.F6)
« Comparison of reoperation rates, perioperative outcomes in women with endometrial cancer when the standard of care shifts from open surgery to laparoscopy », Arch Gynecol Obstet, vol. 290, no 6, 2014, p. 1215–1220 (PMID 25009071, DOI 10.1007/s00404-014-3347-9)
G. Barmparas, B. C. Branco, B. Schnüriger, L. Lam, K. Inaba et D. Demetriades, « The incidence and risk factors of post-laparotomy adhesive small bowel obstruction », J. Gastrointest. Surg., vol. 14, no 10, octobre 2010, p. 1619–28 (PMID 20352368, DOI 10.1007/s11605-010-1189-8)
« Peritoneal Dissemination Complicating Morcellation of Uterine Mesenchymal Neoplasms », PLoS ONE, vol. 7, no 11, 2012, e50058 (PMID 23189178, PMCID 3506532, DOI 10.1371/journal.pone.0050058, Bibcode 2012PLoSO...750058S)
« Parasitic myomas after laparoscopic surgery: An emerging complication in the use of morcellator? Description of four cases », Fertility and Sterility, vol. 96, no 2, 2011, e90–e96 (PMID 21719004, DOI 10.1016/j.fertnstert.2011.05.095)
(en) Center for Devices and Radiological Health, « Safety Communications – UPDATED Laparoscopic Uterine Power Morcellation in Hysterectomy and Myomectomy: FDA Safety Communication », sur www.fda.gov (consulté le 10 janvier 2017)
Hongqian Liu, Theresa A. Lawrie, DongHao Lu et Huan Song, « Robot-assisted surgery in gynaecology », The Cochrane Database of Systematic Reviews, no 12, 10 décembre 2014, CD011422 (ISSN 1469-493X, PMID 25493418, DOI 10.1002/14651858.CD011422)
« Robotically Assisted vs Laparoscopic Hysterectomy Among Women with Benign Gynecologic Disease<alt-title>Prevalence of Robotically Assisted Hysterectomy</alt-title> », JAMA, vol. 309, no 7, 2013, p. 689–698 (PMID 23423414, DOI 10.1001/jama.2013.186)
« Robotic Surgery in Gynecology: An Updated Systematic Review », Obstetrics and Gynecology International, vol. 2011, 2011, p. 1–29 (PMID 22190948, PMCID 3236390, DOI 10.1155/2011/852061)
« Total laparoscopic hysterectomy versus da Vinci robotic hysterectomy: Is using the robot beneficial? », Journal of Gynecologic Oncology, vol. 22, no 4, 2011, p. 253–259 (PMID 22247802, PMCID 3254844, DOI 10.3802/jgo.2011.22.4.253)
« Robotic versus laparoscopic hysterectomy », Current Opinion in Obstetrics and Gynecology, vol. 23, no 4, 2011, p. 283–288 (PMID 21666467, DOI 10.1097/GCO.0b013e328348a26e)
Beri M. Ridgeway, Megan Buechel, Benjamin Nutter et Tommaso Falcone, « Minimally Invasive Hysterectomy: An Analysis of Different Techniques », Clinical Obstetrics and Gynecology, vol. 58, no 4, 1er décembre 2015, p. 732–739 (ISSN 1532-5520, PMID 26457851, DOI 10.1097/GRF.0000000000000149)
« The commercialization of robotic surgery: Unsubstantiated marketing of gynecologic surgery by hospitals », American Journal of Obstetrics and Gynecology, vol. 207, no 3, 2012, p. 174.1e1–7 (PMID 22835493, DOI 10.1016/j.ajog.2012.06.050)
MD Blikkendaal, EM Schepers, EW van Zwet, AR Twijnstra et FW Jansen, « Hysterectomy in very obese and morbidly obese patients: a systematic review with cumulative analysis of comparative studies. », Archives of gynecology and obstetrics, vol. 292, no 4, octobre 2015, p. 723–38 (PMID 25773357)
CR King et D Giles, « Total Laparoscopic Hysterectomy and Laparoscopic-Assisted Vaginal Hysterectomy. », Obstetrics and gynecology clinics of North America, vol. 43, no 3, septembre 2016, p. 463–78 (PMID 27521879)
EM Nesbitt-Hawes, PE Maley, HR Won, KS Law, CS Zhang, SD Lyons, W Ledger et JA Abbott, « Laparoscopic subtotal hysterectomy: evidence and techniques. », Journal of minimally invasive gynecology, vol. 20, no 4, 2013, p. 424–34 (PMID 23510954)
A Lethaby, A Mukhopadhyay et R Naik, « Total versus subtotal hysterectomy for benign gynaecological conditions », The Cochrane database of systematic reviews, no 4, 18 avril 2012, CD004993 (PMID 22513925, DOI 10.1002/14651858.CD004993.pub3)
K. McPherson, M. A. Metcalfe, A. Herbert, M. Maresh, A. Casbard, J. Hargreaves, S. Bridgman et A. Clarke, « Severe complications of hysterectomy: the VALUE study », BJOG, vol. 111, no 7, 2004, p. 688–694 (PMID 15198759, DOI 10.1111/j.1471-0528.2004.00174.x)
P. A. Wingo, C. M. Huezo, G. L. Rubin, H. W. Ory et H. B. Peterson, « The mortality risk associated with hysterectomy », American Journal of Obstetrics and Gynecology, vol. 152, no 7 Pt 1, 1985, p. 803–808 (PMID 4025434, DOI 10.1016/s0002-9378(85)80067-3)
F. N. Burks et R. A. Santucci, « Management of iatrogenic ureteral injury », Ther Adv Urol, vol. 6, no 3, juin 2014, p. 115–24 (PMID 24883109, PMCID 4003841, DOI 10.1177/1756287214526767)
Ureteral Trauma
G. A. Laughlin, E. Barrett-Connor, D. Kritz-Silverstein et D. von Mühlen, « Hysterectomy, oophorectomy, and endogenous sex hormone levels in older women: the Rancho Bernardo Study », J. Clin. Endocrinol. Metab., vol. 85, no 2, 2000, p. 645–51 (PMID 10690870, DOI 10.1210/jc.85.2.645)
C. M. Farquhar, L. Sadler, S. A. Harvey et A. W. Stewart, « The association of hysterectomy and menopause: a prospective cohort study », BJOG, vol. 112, no 7, 2005, p. 956–62 (PMID 15957999, DOI 10.1111/j.1471-0528.2005.00696.x)
E. A. Petri Nahás, A. Pontes, J. Nahas-Neto, V. T. Borges, R. Dias et P. Traiman, « Effect of total abdominal hysterectomy on ovarian blood supply in women of reproductive age », Journal of ultrasound in medicine, vol. 24, no 2, 2005, p. 169–174 (PMID 15661947)
C. P. Maas, P. T. Weijenborg et M. M. ter Kulle, « The effect of hysterectomy on sexual functioning », Annual Review of Sex Research, vol. 14, 2003, p. 83–113 (PMID 15287159)
BR. Komisaruk, E. Frangos et B. Whipple, « Hysterectomy Improves Sexual Response? Addressing a Crucial Omission in the Literature », Journal of Minimally Invasive Gynecology, vol. 18, no 3, 2011, p. 288–295 (PMID 21545957, PMCID 3090744, DOI 10.1016/j.jmig.2011.01.012)
Gunter J, « Chronic Pelvic Pain: An Integrated Approach to Diagnosis and Treatment », Obstetrical & Gynecological Survey, vol. 58, no 9, 2003, p. 615–623 (PMID 12972837, DOI 10.1097/01.OGX.0000083225.90017.01)
E. Ingelsson, C. Lundholm, A. L. Johansson et D. Altman, « Hysterectomy and risk of cardiovascular disease: A population-based cohort study », European Heart Journal, vol. 32, no 6, 2011, p. 745–50 (PMID 21186237, DOI 10.1093/eurheartj/ehq477)
J. L. Kelsey, M. M. Prill, T. H. Keegan, C. P. Quesenberry et S. Sidney, « Risk factors for pelvis fracture in older persons », Am. J. Epidemiol., vol. 162, no 9, 2005, p. 879–86 (PMID 16221810, DOI 10.1093/aje/kwi295)
D. J. van der Voort, P. P. Geusens et G. J. Dinant, « Risk factors for osteoporosis related to their outcome: fractures », Osteoporosis international, vol. 12, no 8, 2001, p. 630–8 (PMID 11580076, DOI 10.1007/s001980170062)
N. R. Watson, J. W. Studd, T. Garnett, M. Savvas et P. Milligan, « Bone loss after hysterectomy with ovarian conservation », Obstetrics and gynecology, vol. 86, no 1, 1995, p. 72–7 (PMID 7784026, DOI 10.1016/0029-7844(95)00100-6)
R. Durães Simões, Chada Baracat, V. L. Szjenfeld, G. R. de Lima, W. José Gonçalves et C. Carvalho Ramos Bortoletto, « Effects of simple hysterectomy on bone loss », Revista paulista de medicina, vol. 113, no 6, 1995, p. 1012–5 (PMID 8731286, DOI 10.1590/s1516-31801995000600003)
M. M. Hreshchyshyn, A. Hopkins, S. Zylstra et M. Anbar, « Effects of natural menopause, hysterectomy, and oophorectomy on lumbar spine and femoral neck bone densities », Obstetrics and gynecology, vol. 72, no 4, 1988, p. 631–8 (PMID 3419740)
R. K. Menon, F. E. Okonofua, J. E. Agnew, M. Thomas, J. Bell, P. M. O'Brien et P. Dandona, « Endocrine and metabolic effects of simple hysterectomy », International journal of gynaecology and obstetrics: the official organ of the International Federation of Gynaecology and Obstetrics, vol. 25, no 6, 1987, p. 459–63 (PMID 2892704, DOI 10.1016/0020-7292(87)90062-2)
S. K. Jassal, E. Barrett-Connor et S. L. Edelstein, « Low bioavailable testosterone levels predict future height loss in postmenopausal women », J. Bone Miner. Res., vol. 10, no 4, 1995, p. 650–4 (PMID 7610937, DOI 10.1002/jbmr.5650100419)
R. Segraves et T. Woodard, « Female hypoactive sexual desire disorder: History and current status », The journal of sexual medicine, vol. 3, no 3, 2006, p. 408–18 (PMID 16681466, DOI 10.1111/j.1743-6109.2006.00246.x)
C. M. Rivera, B. R. Grossardt, D. J. Rhodes et W. A. Rocca, « Increased Mortality for Neurological and Mental Diseases following Early Bilateral Oophorectomy », Neuroepidemiology, vol. 33, no 1, 2009, p. 32–40 (PMID 19365140, PMCID 2697609, DOI 10.1159/000211951)
J. S. Brown, G. Sawaya, D. H. Thom et D. Grady, « Hysterectomy and urinary incontinence: a systematic review », The Lancet, vol. 356, no 9229, 2000, p. 535–539 (PMID 10950229, DOI 10.1016/S0140-6736(00)02577-0)
D. Altman, F. Granath, S. Cnattingius et C. Falconer, « Hysterectomy and risk of stress-urinary-incontinence surgery: nationwide cohort study », The Lancet, vol. 370, no 9597, 2007, p. 1494–1499 (PMID 17964350, DOI 10.1016/S0140-6736(07)61635-3)
K. McPherson, A. Herbert, A. Judge, A. Clarke, S. Bridgman, M. Maresh et C. Overton, « Self-reported bladder function five years post-hysterectomy », Journal of obstetrics and gynaecology, vol. 25, no 5, 2005, p. 469–75 (PMID 16183583, DOI 10.1080/01443610500235170)
A. Lukanovic et K. Drazic, « Risk factors for vaginal prolapse after hysterectomy », International journal of gynaecology and obstetrics: the official organ of the International Federation of Gynaecology and Obstetrics, vol. 110, no 1, 2010, p. 27–30 (PMID 20362288, DOI 10.1016/j.ijgo.2010.01.025)
D. Altman, C. Falconer, S. Cnattingius et F. Granath, « Pelvic organ prolapse surgery following hysterectomy on benign indications », American Journal of Obstetrics and Gynecology, vol. 198, no 5, 2008, p. 572.e1–572.e6 (PMID 18355787, DOI 10.1016/j.ajog.2008.01.012)
Wiseman DM, « Disorders of adhesions or adhesion-related disorder: monolithic entities or part of something bigger—CAPPS? », Semin. Reprod Med., vol. 26, no 4, 2008, p. 356–68 (PMID 18756413, DOI 10.1055/s-0028-1082394, lire en ligne)
Patrick Duff, « Diagnosis and Management of Postoperative Infection », The Global Library of Women's Medicine, 2009(ISSN 1756-2228, DOI 10.3843/GLOWM.10032, lire en ligne)
Barbara Hoffman, Williams gynecology, 2nd edition, New York, McGraw-Hill Medical, 2012(ISBN 0071716726), p. 65
D. Altman, L. Yin, A. Johansson, C. Lundholm et H. Grönberg, « Risk of Renal Cell Carcinoma After Hysterectomy », Archives of Internal Medicine, vol. 170, no 22, 2010, p. 2011–2016 (PMID 21149759, DOI 10.1001/archinternmed.2010.425)
M. Gago-Dominguez, J. E. Castelao, J. M. Yuan, R. K. Ross et M. C. Yu, « Increased risk of renal cell carcinoma subsequent to hysterectomy », Cancer Epidemiology, Biomarkers & Prevention, vol. 8, no 11, 1999, p. 999–1003 (PMID 10566555)
A. Zucchetto, R. Talamini, L. Dal Maso, E. Negri, J. Polesel, V. Ramazzotti, M. Montella, V. Canzonieri, D. Serraino, C. La Vecchia et S. Franceschi, « Reproductive, menstrual, and other hormone-related factors and risk of renal cell cancer », International Journal of Cancer, vol. 123, no 9, 2008, p. 2213–2216 (PMID 18711701, DOI 10.1002/ijc.23750)
P. S. Cocks, « Early ectopic pregnancy after vaginal hysterectomy two case reports », BJOG: an International Journal of Obstetrics and Gynaecology, vol. 87, no 5, 1980, p. 363–365 (DOI 10.1111/j.1471-0528.1980.tb04559.x)
C. D. Quiróz-Guadarrama, J. L. Martínez-Ordaz, M. E. Rojano-Rodríguez, J. L. Beristain-Hernández et M. Moreno-Portillo, « [Vaginal evisceration. Report of a case and a literature review]. », Ginecol Obstet Mex, vol. 81, no 6, juin 2013, p. 349–52 (PMID 23837301)
« Hysterectomy rates falling: report », CBC News, 27 mai 2010(lire en ligne)
« Hysterectomy » [archive du 25 février 2004], National Women’s Health Information Center, 1er juillet 2006(consulté le 7 juin 2007)
1988 article by the New York Times
Gautam Khastgir et John Studd, Hysterectomy and HRT, Taylor & Francis, 1998(ISBN 978-1-85317-408-7, lire en ligne), p. 3
Christine Wolfrum: Vorschnelle Schnitte. In: Apotheken Umschau vom 1. Juni 2008. Wort & Bild Verlag, Baierbrunn. ohne ISSN.
A. Müller, F. C. Thiel, S. P. Renner, M. Winkler, L. Häberle et M. W. Beckmann, « Hysterectomy-a comparison of approaches », Deutsches Ärzteblatt International, vol. 107, no 20, mai 2010, p. 353–9 (PMID 20539807, PMCID 2883234, DOI 10.3238/arztebl.2010.0353)
L. Mettler, N. Ahmed-Ebbiary et T. Schollmeyer, « Laparoscopic hysterectomy: challenges and limitations », Minimally Invasive Therapy & Allied Technologies, vol. 14, no 3, 2005, p. 145–59 (PMID 16754157, DOI 10.1080/13645700510034010)
C. Jäger, G. Sauer et R. Kreienberg, « Die laparoskopisch assistierte vaginale Hysterektomie – Sinn oder Unsinn? », Geburtshilfe und Frauenheilkunde, vol. 67, no 6, 2007, p. 628–632 (ISSN 0016-5751, DOI 10.1055/s-2007-965243)
H. Gimbel, A. Settnes et A. Tabor, « Hysterectomy on benign indication in Denmark 1988–1998. A register based trend analysis », Acta Obstetricia et Gynecologica Scandinavica, vol. 80, no 3, mars 2001, p. 267–72 (PMID 11207494, DOI 10.1080/j.1600-0412.2001.080003267.x)
Liens externes |
- (en) « Hysterectomy », sur DMOZ
- (en) « Hysterectomy », sur MedlinePlus Encyclopedia
- Oncolex.org features live footage videos showing radical hysterctomies
Hudson's FTM Resource Guide, "FTM Gender Reassignment Surgery- Sabine de La Brosse « Hystérectomie. La chirurgie cœlioscopique robotisée » sur Paris Match, le 26 mars 2013.
- Portail de la médecine
- Portail de la transidentité






