Hydroxytoluène butylé
| Hydroxytoluène butylé | |
 | |
| Identification | |
|---|---|
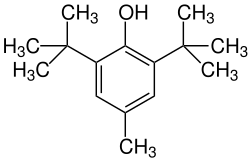
Nom UICPA | 2,6-di-tert-butyl-4-méthylphénol |
Synonymes | BHT |
No CAS | |
| NoECHA | 100.004.439 |
No CE | 204-881-4 |
No E | E321 |
FEMA | 2184 |
SMILES | c1(c(O)c(C(C)(C)C)cc(c1)C)C(C)(C)C , |
InChI | InChI : InChI=1/C15H24O/c1-10-8-11(14(2,3)4)13(16)12(9-10)15(5,6)7/h8-9,16H,1-7H3 |
| Apparence | cristaux ou poudre incolores à jaune pâle[1]. |
| Propriétés chimiques | |
Formule brute | C15H24O [Isomères] |
Masse molaire[2] | 220,3505 ± 0,014 g/mol C 81,76 %, H 10,98 %, O 7,26 %, |
| Propriétés physiques | |
T° fusion | 70 °C[1] |
T° ébullition | 265 °C[1] |
Solubilité | dans l'eau à 25 °C : 0,0006 g·l-1[1] |
Masse volumique | 1,03–1,05 g·cm-3[1] |
Point d’éclair | 127 °C (coupelle fermée)[1] |
Pression de vapeur saturante | à 20 °C : 1,3 Pa[1] |
| Précautions | |
| NFPA 704 | |
1 2 0 | |
| Directive 67/548/EEC | |
 Xn Symboles : Xn : Nocif Phrases R : R22 : Nocif en cas d’ingestion. R36/37/38 : Irritant pour les yeux, les voies respiratoires et la peau. Phrases S : S26 : En cas de contact avec les yeux, laver immédiatement et abondamment avec de l’eau et consulter un spécialiste. S37/39 : Porter des gants appropriés et un appareil de protection des yeux/du visage. Phrases R : 22, 36/37/38, Phrases S : 26, 37/39, | |
| Classification du CIRC | |
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[3] | |
| Écotoxicologie | |
LogP | 5,1[1] |
| Unités du SI et CNTP, sauf indication contraire. | |
modifier | |
L’hydroxytoluène butylé ou BHT est un conservateur utilisé comme additif alimentaire ainsi que dans les produits d'hygiène. Il s’agit du 2,6-di-tert-butyl-4-méthylphénol ou 2,6-bis(1,1-diméthyléthyl)-4-méthylphénol. Puissant antioxydant synthétique, son utilisation est controversée et il semble que trop peu d'études aient été menées à son sujet.
Il résiste aux fortes températures qui peuvent être atteintes lors de la fabrication du produit, contrairement à certains antioxydants comme la vitamine E.
Sommaire
1 Synthèse
2 Utilisations
3 Effet potentiellement nocif
4 Effet sur l'environnement
5 Alternatives
6 Références
Synthèse |
Le BHT s'obtient uniquement par voie de synthèse: réaction d'alkylation entre le p-crésol et l'isobutylène. C'est un procédé qui se fait en plusieurs étapes. La première étape consiste en une catalyse acide entre le p-crésol et l’isobutylène avec comme catalyseur l’acide sulfurique. Vient ensuite l’ajout du carbonate de sodium pour la neutralisation. Et enfin s’en suit de son étapes de filtration, lavage, cristallisation par l’isopropanol et le séchage[4].
Utilisations |
Il est utilisé dans l'industrie agroalimentaire et cosmétique, souvent en remplacement du BHA[5]. Il est présent dans 99% des produits cosmétiques pour prévenir de leurs oxydation. On le trouve souvent en faible quantité dans les rouges et baumes à lèvres, crèmes de soin, fonds de teint et produits de traitement des cheveux[6]. On le retrouve également dans les aliments riches en matières grasses, les céréales, la viande, les soupes déshydratées[6]. Il serait métabolisé en cas d'ingestion et soupçonné d'être allergène et cancérogène. Les contaminants possibles sont cendres sulfuriques, arsenic, métaux lourds.
Il porte le code E321 dans l’Union européenne et se présente sous la forme d'une poudre ou de cristaux incolores à jaune pâle.
Le BHT est aussi utilisé pour stabiliser le diéthyléther, ce dernier ayant tendance à former des peroxydes explosifs au contact de l'air.
Effet potentiellement nocif |
Le BHT est suspecté d’être un perturbateur endocrinien[réf. nécessaire][7]. De fortes doses de BHT pourraient simuler l’œstrogène, hormone sexuelle féminine, en se fixant aux récepteurs d'œstrogènes, ainsi qu’empêcher l’expression des hormones sexuelles masculines, ce qui entraînerait des effets néfastes en matière de reproduction.
Le Centre international de recherche sur le cancer (CIRC) classe le BHA parmi les cancérigènes possibles, et le BHT parmi les substances dont l’innocuité n’a pas pu être établie, mais il pourrait favoriser le développement de tumeurs déjà existantes.
BHT et BHA sont aussi réputés d’être dotés d’un potentiel sensibilisant, pouvant être responsables d’allergies.
Par ailleurs, ils sont absorbés et métabolisés, c’est-à-dire transformés par les organismes vivants, peuvent induire des dysfonctionnements et des perturbations au niveau de différents organes, animaux ou humains. Après absorption, chez l'homme, seuls 50 % du BHT seraient éliminés par voie urinaire au cours des 24 h suivant, et 65 % au cours des 10-11 jours suivant son absorption[8].
Deux femmes sont tombés gravement malade après avoir ingéré fortes doses de BHT (67mg/kg de masse corporelle et 1,3g/kg de masse corporelle). Elles ont souffert de troubles de l’élocution, de crampes à l’estomac, de nausées, d’étourdissements et de pertes de connaissance[4].
Une exposition, à long terme et à fortes doses, au BHT, est toxique pour les animaux de laboratoire. Des études ont été faites sur des souris, exposés à des doses de 2.5g/kg. Ses effets sont alors nocifs à plusieurs niveaux : modifications du système immunitaire et de la formule sanguine avec notamment une perturbation de la coagulation du sang, hypertrophie du foie, atteinte de la glande thyroïde et des reins, modifications biochimiques des poumons, détresse respiratoire[8],[4].
Effet sur l'environnement |
Le BHT a aussi des répercussions sur l'environnement. En effet, lorsque celui-ci est utilisé dans les produits cosmétiques, le BHT évite le rancissement des graisses[7] (parfois changement de couleurs, odeur désagréable[9].) et agit autant qu' anti-oxydant.Il est difficile de définir l'impact du BHT pour l'eau: le BHT ne se dissout par dans l'eau. Cependant, il n'est pas biodégradable, et à donc un fort pouvoir bioaccumulant[8]. Les rejets dans l'environnement lors de l'utilisation du BHT et de tout ce qui constitue cette substance( maquillages, gels, crèmes de rasages, parfums.. ) ne sont pas quantifiables[10]. Dans l'environnement, le BHT se décompose rapidement pour former plusieurs métabolites[10]. Ainsi, il apparaît comme étant détenteur d’une forte toxicité dans le milieu aquatique et ainsi se bioaccumule dans le temps; il présente un potentiel de bioaccumulation modéré à élevé chez les espèces aquatiques. Ce qui a un effet direct sur les animaux aquatiques[4].
Alternatives |
Comme alternative, des antioxydants alternatifs pourraient être crées à la place du BHT. Qu'ils soient d'origine synthétiques ou d'origine naturelles[7]. La présence du BHT dans nos produits cosmétiques du quotidien, est du au fait, que ceux-ci sont très accessibles au niveau de leurs coût de production.La vitamine E, pourrait aussi faire effet grâce à son action antioxydante[8].
Références |
HYDROXYTOLUENE BUTYLE, fiche(s) de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée(s) le 9 mai 2009
Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme »(Archive • Wikiwix • Archive.is • Google • Que faire ?), sur http://monographs.iarc.fr, CIRC, 16 janvier 2009(consulté le 22 août 2009)
« Re-evaluation of butylated hydroxytoluene - BHT (E 321) as a food additive », sur European Food Safety Authority, 7 mars 2012(consulté le 31 décembre 2018)
Produits cosmétiques, les fiches des molécules toxiques à éviter, UFC Que Choisir, juin 2017
« fiche d'information sur le BHT et le BHA », sur www.sabotage-hormonal.org (consulté le 31 décembre 2018)
« OFFICINEA », 25 avril 2017(consulté le 31 décembre 2018)
« le BHT », sur www.scc-quebec.org (consulté le 31 décembre 2018)
Éditions Larousse, « Définitions : rancissement - Dictionnaire de français Larousse », sur www.larousse.fr (consulté le 31 décembre 2018)
« Healthier Life », 19 janvier 2013
- Portail de la chimie

